Sel Galvani atau sel volta adalah sel elektrokimia yang dapat menyebabkan terjadinya energi listrik dari suatu reaksi redoks yang spontan
KPAN
Katoda → elektroda Positif
Anoda → elektroda Negatif
ANOKARE
ANoda → tempat terjadi reaksi Oksidasi
KAtoda → tempat terjadi reaksi REduksi
Bagan Sel Volta
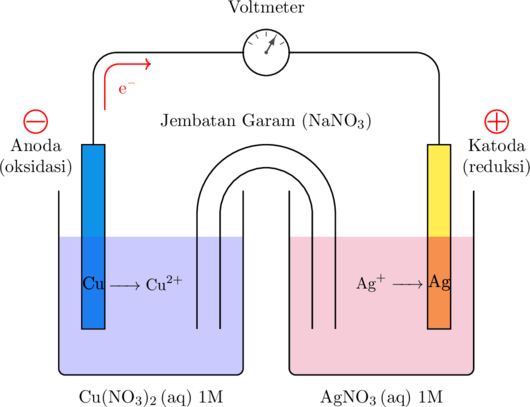
Keterangan:
- Sel volta terdiri dari dua buah kompartemen yang masing-masing berisi larutan dan elektroda yang terhubung oleh jembatan garam
- Batang tembaga (Cu) menjadi elektroda negatif (anoda) sedangkan batang perak (Ag) menjadi elektroda positif (katoda)
- Kedua elektroda tersebut dihubungkan dengan kawat untuk mengalirkan elektron. Elektron akan mengalir dari anoda ke katoda.
- Beda potensial antara kedua elektroda diukur menggunakan voltmeter
- Reaksi oksidasi terjadi di anoda
\(\ce {Cu(s)} \longrightarrow \ce{Cu^{2+}(aq) + 2e^-}\)
- Reaksi reduksi terjadi di katoda
\(\ce {Ag^{+}(aq) + e^-} \longrightarrow \ce {Ag(s)}\)
- Penulisan notasi sel:
\(\ce {Cu(s) } \arrowvert \ce{Cu^{2+}(aq) }\rVert \ce { Ag^{+}(aq) }\arrowvert \ce { Ag(s)}\)
- Jembatan garam berisi gel yang mengandung garam yang berfungsi untuk menyeimbangkan jumlah muatan pada kedua kompartemen. Jembatan garam akan menyebabkan reaksi tidak cepat menuju kesetimbangan
- Saat reaksi sudah mencapai kesetimbangan, voltmeter akan menunjukkan angka 0 volt, artinya sudah tidak ada lagi elektron yang mengalir. Pada kondisi ini sel volta sudah tidak mampu menghasilkan energi listrik.
- Potensial standar sel dapat dihitung dengan rumus: \(\text{E}^{\circ}_{\text{ sel}} = \text{E}^{\circ}_{\text{ katoda}} – \text{ E}^{\circ}_{\text{ anoda} }\)
Contoh:
Diketahui data potensial reduksi standar:
\(\ce{Cu^2+ (aq) + 2e^-} \rightleftharpoons \ce{Cu(s)}\:\:\:\:\:\text{E}^{\circ} = +0,34 \text{ V}\)
\(\ce{Ag^+ (aq) + e^-} \rightleftharpoons \ce{Ag(s)}\:\:\:\:\:\text{E}^{\circ} = +0,80 \text{ V}\)
Elektroda yang memiliki potensial reduksi standar terbesar yaitu perak akan menjadi katoda karena perak mudah mengalami reduksi.
Elektroda yang memiliki potensial reduksi standar terkecil yaitu tembaga akan menjadi anoda karena tembaga mudah mengalami oksidasi.
\(\text{E}^{\circ}_{\text{ sel}} = \text{E}^{\circ}_{\text{ katoda}} – \text{ E}^{\circ}_{\text{ anoda} }\)
\(\text{E}^{\circ}_{\text{ sel}} = 0,80 – 0,34 = 0,46 \text{ V}\)
Deret Kereaktifan Logam
Deret kereaktifan logam disebut juga dengan deret volta menunjukkan urutan nilai potensial reduksi standar. Potensial reduksi standar diukur pada kondisi suhu 25°C, tekanan 100 kPa, dan konsentrasi larutan ion 1 M.
| $$\underleftrightarrow {\ce{Li K Ba Ca Na Mg Al Mn [H2O] Zn Cr Fe Cd Co Ni Sn Pb [H] Cu Hg Ag Pt Au}}$$ | |
| \(\text{E}^{\circ}_{\text{sel }} \text{ kecil }(-)\)
mudah mengalami oksidasi pereduksi terkuat (reduktor kuat) |
\(\text{E}^{\circ}_{\text{sel }} \text{ besar } (+)\)
mudah mengalami reduksi oksidator kuat |
Contoh Soal
Soal 1
Sel volta disusun menggunakan larutan \(\ce {Zn(NO3)2 (aq)} \text{ 1 M}\) berada di kompartemen sebelah kiri dan larutan \(\ce{AgNO3} \text{ 1 M}\) berada di kompartemen sebelah kanan. Data potensial reduksi standar untuk seng dan perak:
\(\ce{Zn^{2+} (aq) + 2e^-} \rightleftharpoons \ce{Zn(s)}\:\:\:\:\:\text{E}^{\circ} = -0,76 \text{ V}\)
\(\ce{Ag^+ (aq) + e^-} \rightleftharpoons \ce{Ag(s)}\:\:\:\:\:\text{E}^{\circ} = +0,80 \text{ V}\)
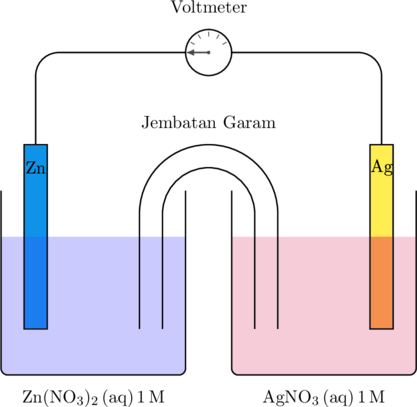
Berdasarkan bagan sel volta di atas, tentukan:
a. Logam yang mengalami oksidasi dan logam yang mengalami reduksi
b. Anoda dan Katoda
c. Persamaan reaksi oksidasi dan reaksi reduksi
d. Arah aliran elektron pada kawat
e. Zat yang sesuai pada jembatan garam beserta fungsinya
f. Besar potensial standar sel
g. Notasi sel
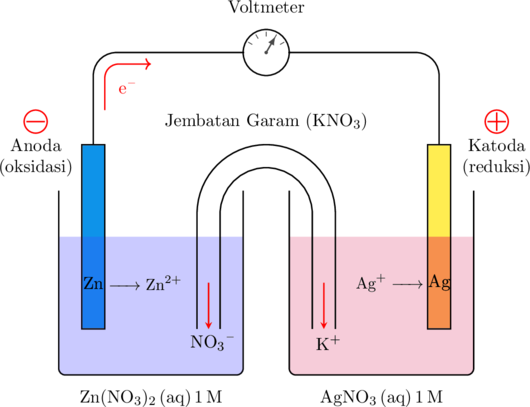
a. Logam yang mengalami oksidasi adalah seng karena memiliki nilai potensial reduksi standar yang kecil. Logam yang mengalami reduksi adalah perak karena memiliki nilai potensial reduksi standar yang besar
b. Anoda adalah tempat terjadinya oksidasi, sehingga logam yang bertindak sebagai anoda adalah seng. Katoda adalah tempat terjadinya reduksi, sehingga logam yang bertindak sebagai katoda adalah perak.
c. Persamaan reaksi oksidasi dan reduksi:
Oksidasi : \(\ce{Zn (s)}\rightleftharpoons \ce{Zn^{2+} (aq) + 2e^-} \)
Reduksi : \( \ce{Ag^{+} (aq) + e^-} \rightleftharpoons \ce{Ag(s)}\)
d. Elektron mengalir dari anoda ke katoda
e. Zat yang berada di dalam jembatan garam \(\ce{KNO3}\)
Ion \(\ce{NO3^-}\) akan menuju kompartemen sebelah kiri tempat oksidasi berlangsung dan menyeimbangkan jumlah muatan di sana
Ion \(\ce{K^+}\) akan menuju kompartemen sebelah kanan tempat reduksi berlangsung dan menyeimbangkan jumlah muatan di sana
f. Potensial standar sel:
\(\text{E}^{\circ}_{\text{ sel}} = \text{E}^{\circ}_{\text{ katoda}} – \text{ E}^{\circ}_{\text{ anoda} }\)
\(\text{E}^{\circ}_{\text{ sel}} = 0,80 – (-0,76) = 1,56 \text{ V}\)
g. Penulisan notasi sel:
\(\ce {Zn(s) } \arrowvert \ce{Zn^{2+}(aq) }\rVert \ce { Ag^{+}(aq) }\arrowvert \ce { Ag(s)}\)
Soal 2
UN 2017
Perhatikan potensial elektrode standar berikut!
\(\ce{Cr^{3+} (aq) + 3e} \rightarrow \ce{Cr(s)}\:\:\:\:\:\text{E}^{\circ} = -0,71 \text{Volt}\)
\(\ce{Ag^{+} (aq) + e} \rightarrow \ce{Ag(s)}\:\:\:\:\:\text{E}^{\circ} = +0,80 \text{Volt}\)
\(\ce{Al^{3+} (aq) + 3e} \rightarrow \ce{Al(s)}\:\:\:\:\:\text{E}^{\circ} = -1,66 \text{Volt}\)
\(\ce{Zn^{2+} (aq) + 2e} \rightarrow \ce{Zn(s)}\:\:\:\:\:\text{E}^{\circ} = -0,74 \text{Volt}\)
Diagram sel yang dapat berlangsung spontan adalah…
A. \(\ce {Ag(s) } \arrowvert \ce{Ag^{+}(aq) }\rVert \ce { Cr^{3+}(aq) }\arrowvert \ce { Cr(s)}\)
B. \(\ce {Ag(s) } \arrowvert \ce{Ag^{+}(aq) }\rVert \ce { Zn^{2+}(aq) }\arrowvert \ce { Zn(s)}\)
C. \(\ce {Cr(s) } \arrowvert \ce{Cr^{3+}(aq) }\rVert \ce { Al^{3+}(aq) }\arrowvert \ce { Al(s)}\)
D. \(\ce {Zn(s) } \arrowvert \ce{Zn^{2+}(aq) }\rVert \ce { Al^{3+}(aq) }\arrowvert \ce { Al(s)}\)
E. \(\ce {Zn(s) } \arrowvert \ce{Zn^{2+}(aq) }\rVert \ce { Ag^{+}(aq) }\arrowvert \ce { Ag(s)}\)
Jawaban: E
\(\text{E}^{\circ}_{\text{ sel}} = \text{E}^{\circ}_{\text{ katoda}} – \text{ E}^{\circ}_{\text{ anoda} }\)
\(\underbrace{\ce {Ag(s) } \arrowvert \ce{Ag^{+}(aq) }}_{\text{oksidasi di anoda}}\rVert \underbrace{\ce { Cr^{3+}(aq) }\arrowvert \ce { Cr(s)}}_{\text{reduksi di katoda}}\)
A. \(\text{E}^{\circ}_{\text{ sel}} = -0,71 – 0,80 = -1,51 \text{ V}\:\:\:\color{red} \text{tidak spontan}\)
B. \(\text{E}^{\circ}_{\text{ sel}} = -0,74 – 0,80 = -1,54 \text{ V}\:\:\:\color{red} \text{tidak spontan}\)
C. \(\text{E}^{\circ}_{\text{ sel}} = -1,66 – (-0,71) = -0,95 \text{ V}\:\:\:\color{red} \text{tidak spontan}\)
D. \(\text{E}^{\circ}_{\text{ sel}} = -1,66 – (-0,74)= -0,92 \text{ V}\:\:\:\color{red} \text{tidak spontan}\)
E. \(\text{E}^{\circ}_{\text{ sel}} = +0,80 – (-0,74) = +1,54 \text{ V}\:\:\:\color{blue} \text{reaksi berlangsung spontan}\)
Soal 3
UN 2010
Suatu sel volta disusun seperti pada bagan berikut:
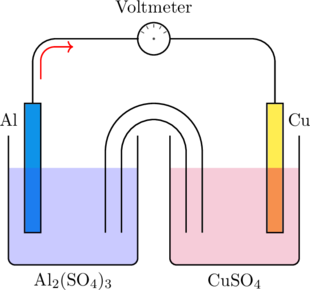
Diagram sel volta yang benar adalah…
A. \(\ce {Al(s) } \arrowvert \ce{Al^{3+}(aq) }\rVert \ce { Cu^{2+}(aq) }\arrowvert \ce { Cu(s)}\)
B. \(\ce {Al^{3+}(aq) } \arrowvert \ce{Al(s) }\rVert \ce { Cu(s) }\arrowvert \ce { Cu^{2+}(aq)}\)
C. \(\ce {Cu^{2+}(aq) } \arrowvert \ce{Cu(s) }\rVert \ce { Al(s) }\arrowvert \ce { Al^{3+}(aq)}\)
D. \(\ce {Cu(s) } \arrowvert \ce{Cu^{2+}(aq) }\rVert \ce { Al^{3+}(aq) }\arrowvert \ce { Al(s)}\)
E. \(\ce {Al(s) } \arrowvert \ce{Cu^{2+}(aq) }\rVert \ce { Al^{3+}(aq) }\arrowvert \ce { Cu(s)}\)
Jawaban: A
Arah aliran elektron dari anode ke katode
Aluminium menjadi elektroda negatif (anoda), sedangkan tembaga menjadi elektroda positif (katoda)
Di anoda terjadi reaksi oksidasi : \(\ce{Al(s)} \rightarrow \ce{Al^{3+}(aq) + 3e^-}\)
Di katoda terjadi reaksi reduksi : \(\ce{Cu^{2+}(aq) + 2e^-} \rightarrow \ce{Cu(s)}\)
Notasi sel: \(\ce {Al(s) } \arrowvert \ce{Al^{3+}(aq) }\rVert \ce { Cu^{2+}(aq) }\arrowvert \ce { Cu(s)}\)
Soal 4
Diketahui data potensial standar sel sebagai berikut:
\(\ce {P } \arrowvert \ce{P^+}\rVert \ce { R^{2+} }\arrowvert \ce { R}\:\:\:\:\:\text{E}^{\circ} = +3,55 \text{ Volt}\)
\(\ce {Q } \arrowvert \ce{Q^{2+}}\rVert \ce { R^{2+} }\arrowvert \ce { R}\:\:\:\:\:\text{E}^{\circ} = +0,98 \text{ Volt}\)
\(\ce {P } \arrowvert \ce{P^+}\rVert \ce { S^{2+} }\arrowvert \ce { S}\:\:\:\:\:\text{E}^{\circ} = +2,47 \text{ Volt}\)
a. Susunlah P, Q, R, dan S berdasarkan daya pereduksi dari yang paling kuat sampai paling lemah
b. Tentukan potensial standar sel untuk \(\ce {S } \arrowvert \ce{S^{2+}}\rVert \ce { Q^{2+} }\arrowvert \ce { Q}\)

Jika kita prediksi letak P, Q, R, dan S dalam deret volta, zat yang mengalami oksidasi terletak di sebelah kiri zat yang mengalami reduksi, sehingga:
- P terletak di sebelah kiri R sejauh 3,55
- Q terletak di sebelah kiri R sejauh 0,98
- P terletak di sebelah kiri S sejauh 2,47
a. Zat yang paling kiri memiliki daya pereduksi yang paling kuat, sehingga urutan pereduksi dari yang paling kuat sampai terlemah adalah: P > S > Q > R
b. Potensial standar sel untuk \(\ce {S } \arrowvert \ce{S^{2+}}\rVert \ce { Q^{2+} }\arrowvert \ce { Q}\) dapat kita hitung dengan menentukan jarak antara S dan Q.
\(\text{E}^{\circ} = 3,55 – 2,47 – 0,98 = 0,10 \text{ Volt}\)
Soal 5
Diketahui data beberapa reaksi:
\(\ce {A(s) + C^{2+}(aq)} \rightarrow \ce{A^{2+}(aq) + C(s)}\:\:\:\text{E}^{\circ} = -1,61 \text{ Volt}\)
\(\ce {D(s) + B^{2+}(aq)} \rightarrow \ce{D^{2+}(aq) + B(s)}\:\:\:\text{E}^{\circ} = -0,78 \text{ Volt}\)
\(\ce {C(s) + B^{2+}(aq)} \rightarrow \ce{C^{2+}(aq) + B(s)}\:\:\:\text{E}^{\circ} = +0,32 \text{ Volt}\)
a. Susunlah A, B, C, dan D berdasarkan daya pereduksi dari paling lemah sampai paling kuat
b. Tentukan potensial standar sel: \(\ce {D(s) + A^{2+}(aq)} \rightarrow \ce{D^{2+}(aq) +A(s)}\)
Reaksi pertama dan kedua tidak spontan karena memiliki nilai potensial sel yang negatif sehingga reaksinya harus dibalik agar berlangsung spontan
\(\ce {C(s) + A^{2+}(aq)} \rightarrow \ce{C^{2+}(aq) + A(s)}\:\:\:\text{E}^{\circ} = +1,61 \text{ Volt}\)
\(\ce {B(s) + D^{2+}(aq)} \rightarrow \ce{B^{2+}(aq) + D(s)}\:\:\:\text{E}^{\circ} = +0,78 \text{ Volt}\)
\(\ce {C(s) + B^{2+}(aq)} \rightarrow \ce{C^{2+}(aq) + B(s)}\:\:\:\text{E}^{\circ} = +0,32 \text{ Volt}\)

Kita prediksi letak A, B, C, dan D dalam deret volta, zat yang mengalami oksidasi terletak di sebelah kiri zat yang mengalami reduksi
C mengalami oksidasi dan A mengalami reduksi, sehingga C berada di sebelah kiri A sejauh 1,61
B mengalami oksidasi dan D mengalami reduksi, sehingga B berada di sebelah kiri D sejauh 0,78
C mengalami oksidasi dan B mengalami reduksi, sehingga C berada di sebelah kiri B sejauh 0,32
a. Pereduksi terkuat berada di sebelah kiri deret volta, sehingga pereduksi terkuat adalah C. Urutan pereduksi dari yang lemah sampai yang paling kuat: A < D < B < C
b. Potensial standar sel \(\ce {D(s) + A^{2+}(aq)} \rightarrow \ce{D^{2+}(aq) +A(s)}\) dapat kita hitung dengan mengukur jarak D ke A.
\(\text{E}^{\circ} = 1,61 – 0,32 – 0,78 = 0,51 \text{ Volt}\)
Soal 6
Tunjukkan apakah logam yang dicelupkan dalam larutan-larutan berikut dapat bereaksi atau tidak
a. \(\ce{Cu}\text{ dalam } \ce{Mg(NO3)2}\)
b. \(\ce{Pb}\text{ dalam } \ce{Cu(NO3)2}\)
c. \(\ce{Zn}\text{ dalam } \ce{FeSO4}\)
d. \(\ce{Fe}\text{ dalam } \ce{Zn(NO3)2}\)
Logam A dapat mendesak ion logam B dalam larutan jika A terletak di sebelah kiri logam B dalam deret volta, sehingga reaksi dapat berlangsung
a. \(\ce{Cu}\text{ dalam } \ce{Mg(NO3)2}\:\:\:\color{red}\text{ tidak terjadi reaksi}\)
\(\ce{Cu}\) tidak dapat mendesak ion \(\ce{Mg^{2+}}\) karena \(\ce{Cu}\) berada di sebelah kanan \(\ce{Mg}\)
b. \(\ce{Pb}\text{ dalam } \ce{Cu(NO3)2}\:\:\:\color{blue}\text{ terjadi reaksi}\)
\(\ce{Pb}\) dapat mendesak ion \(\ce{Cu^{2+}}\) karena \(\ce{Pb}\) berada di sebelah kiri \(\ce{Cu}\)
c. \(\ce{Zn}\text{ dalam } \ce{FeSO4}\:\:\:\color{blue}\text{ terjadi reaksi}\)
\(\ce{Zn}\) dapat mendesak ion \(\ce{Fe^{2+}}\) karena \(\ce{Zn}\) berada di sebelah kiri \(\ce{Fe}\)
d. \(\ce{Fe}\text{ dalam } \ce{Zn(NO3)2}\:\:\:\color{red}\text{ tidak terjadi reaksi}\)
\(\ce{Fe}\) tidak dapat mendesak ion \(\ce{Zn^{2+}}\) karena \(\ce{Fe}\) berada di sebelah kanan \(\ce{Zn}\)
