“Perbandingan massa unsur-unsur dalam suatu senyawa adalah tertentu tetap“
CONTOH SOAL
Contoh 1
UN SMA 2017
Perhatikan tabel berikut ini!
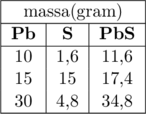
Jika massa \(\ce{Pb}\) yang digunakan sebanyak 25 g, massa \(\ce{S}\) yang diperlukan sebanyak …
(A) 1 gram
(B) 2 gram
(C) 4 gram
(D) 5 gram
(E) 6 gram
Jawaban: C
Persamaan reaksi:
\(\ce{Pb} + \ce{S} \rightarrow \ce{PbS}\)
Berdasarkan hukum Lavoisier, massa zat pereaksi = massa zat hasil reaksi.
Percobaan pertama pada tabel menunjukkan bahwa massa \(\ce{Pb}\) + massa \(\ce{S}\) = massa \(\ce{PbS}\)
\(10 \text{ g} + 1,6 \text{ g} = 11,6 \text{ g}\)
Perbandingan massa \(\ce{Pb}\) dan \(\ce{S}\) dalam senyawa \(\ce{PbS}\) adalah 10 : 1,6 atau dapat ditulis 25 : 4
Jika massa \(\ce{Pb}\) yang digunakan sebanyak 25 g, massa \(\ce{S}\) yang diperlukan sebanyak \(\dfrac{4}{25}\times 25 \text{ g} = 4 \text{ g}\)
Jadi, massa \(\ce{S}\) yang diperlukan sebanyak 4 gram
Contoh 2
UN SMA 2015
Magnesium dapat bereaksi dengan oksigen membentuk magnesium oksida dengan perbandingan massa sebagai berikut:
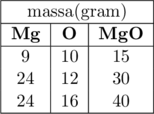
Berdasarkan data tersebut, perbandingan massa \(\ce{Mg}\) dengan \(\ce{O}\) dalam senyawa tersebut adalah …
(A) 4 : 3
(B) 3 : 4
(C) 3 : 2
(D) 2 : 3
(E) 2 : 1
Jawaban: C
Persamaan reaksi:
\(\ce{Mg} + \ce{O} \rightarrow \ce{MgO}\)
Berdasarkan hukum Lavoisier, massa zat pereaksi = massa zat hasil reaksi.
Baris ke-4 pada tabel menunjukkan bahwa massa \(\ce{Mg}\) + massa \(\ce{O}\) = massa \(\ce{MgO}\)
\(24 \text{ g} + 16 \text{ g} = 40 \text{ g}\)
Perbandingan massa \(\ce{Mg}\) dan \(\ce{O}\) dalam senyawa \(\ce{MgO}\) adalah 24 : 16 atau dapat ditulis 3 : 2
Contoh 3
Perbandingan massa unsur magnesium dengan massa oksigen dalam senyawa magnesium oksida adalah 3 : 2. Jika 12 gram magnesium direaksikan dengan oksigen untuk membentuk senyawa magnesium oksida, massa magnesium oksida yang dihasilkan adalah …
(A) 10 gram
(B) 12 gram
(C) 14 gram
(D) 18 gram
(E) 20 gram
Jawaban: E
Mg + O → MgO
Mg : O = 3 : 2
Massa magnesium yang direaksikan 12 gram
Massa oksigen yang dibutuhkan = \(\dfrac{2}{3}\times 12 \text{ g}\)
Massa oksigen yang dibutuhkan = \(8 \text{ g}\)
Berdasarkan hukum Lavoisier, massa zat pereaksi = massa zat hasil reaksi.
Massa magnesium + massa oksigen = massa magnesium oksida
12 gram + 8 gram = massa magnesium oksida
20 gram = massa magnesium oksida
Jadi, massa magnesium oksida yang dihasilkan adalah 20 gram
Contoh 4
Perbandingan massa unsur magnesium dengan massa oksigen dalam senyawa magnesium oksida adalah 3 : 2. Jika 12 gram magnesium direaksikan dengan 15 gram oksigen berlebih untuk membentuk senyawa magnesium oksida, massa oksigen yang tersisa adalah …
(A) 6 gram
(B) 7 gram
(C) 8 gram
(D) 9 gram
(E) 10 gram
Jawaban: B
Mg + O → MgO
Mg : O = 3 : 2
Massa magnesium yang direaksikan 12 gram
Massa oksigen yang dibutuhkan pada saat reaksi = \(\dfrac{2}{3}\times 12 \text{ g}\)
Massa oksigen yang dibutuhkan pada saat reaksi = \(8 \text{ g}\)
Karena oksigen yang disediakan mula-mula sebanyak 15 gram, maka pada akhir reaksi akan terdapat sisa oksigen sebanyak 15 gram − 8 gram = 7 gram
Jadi, massa oksigen yang tersisa pada akhir reaksi adalah 7 gram
