Sel elektrolisis mengubah energi listrik menjadi energi kimia.
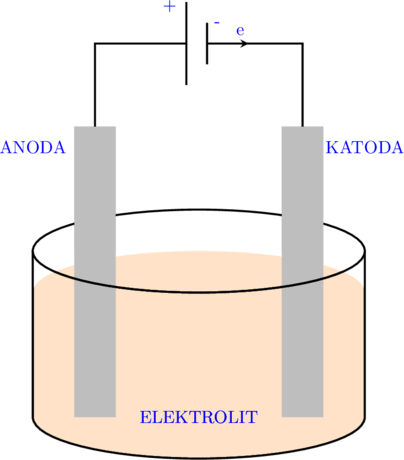
KUTUB POSITIF = ANODA
KUTUB NEGATIF = KATODA
Pada anoda terjadi reaksi oksidasi sedangkan pada katoda terjadi reaksi reduksi
Reaksi di katoda bergantung pada jenis kation:
(1) Jika katoda merupakan logam aktif (golongan IA, IIA, Al dan Mn), yang tereduksi adalah air.
$$\bbox[white, 5px, border: 2px solid red] {2\ce{H2O}_{(l)} + 2e^{-} \rightarrow \ce{H2}_{(g)} +2 \ce{OH}^{-}_{(aq)}}$$
(2) Jika kation bukan logam aktif, kation yang akan tereduksi.
$$\bbox[white, 5px, border: 2px solid red] {2\ce{H}^{+}_{(aq)} + 2e \rightarrow \ce{H2}_{(g)}}$$
$$\bbox[white, 5px, border: 2px solid red] {\ce{L}^{x+}_{(aq)} + xe \rightarrow \ce{L}_{(s)}}$$
Reaksi di anoda bergantung pada jenis anoda dan anion
(1) Anoda inert [Pt, Au, grafit (C)]
- Jika ada sisa asam oksi, air akan teroksidasi
$$\bbox[white, 5px, border: 2px solid red] {2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-}}$$
- Jika ada sisa asam lain atau \(\ce{OH}^{-}\), anion akan teroksidasi
Contoh:
$$\bbox[white, 5px, border: 2px solid red] {2\ce{Br}^{-}_{(aq)} \rightarrow \ce{Br2}_{(aq)} + 2e^{-}}$$
$$\bbox[white, 5px, border: 2px solid red] {4\ce{OH}^{-}_{(aq)} \rightarrow 2\ce{H2O}_{(l)} + \ce{O2}_{(g)} + 4e^{-}}$$
(2) Anoda tidak inert
Anoda yang akan teroksidasi
$$\bbox[white, 5px, border: 2px solid red] {\ce{L}_{(s)} \rightarrow \ce{L}^{x+}_{(aq)} + xe^{-}}$$
Menghitung jumlah mol elektron
$$\bbox[white, 5px, border: 2px solid red] {\text{ 1 mol elektron = 1 Faraday}}$$
$$\bbox[white, 5px, border: 2px solid red] {\text{Jumlah mol elektron} = \dfrac{i \cdot t}{96.500}}$$
Note:
\(i = \text{ kuat arus listrik}\)
\(t = \text{ waktu}\)
Soal Latihan
Soal 01
Tuliskan reaksi elektrolisis pada anoda dan katoda untuk larutan natrium sulfat dengan elektroda karbon.
Reaksi ionisasi natrium sulfat:
\(\ce{Na2SO4}_{(aq)} \rightarrow 2\ce{Na}^{+}_{(aq)} + \ce{SO4}^{2-}_{(aq)}\)
Terdapat kation \(\ce{Na}^{+}\). Karena natrium termasuk logam aktif maka yang mengalami reaksi reduksi adalah air.
Reaksi reduksi di katoda: \(2\ce{H2O}_{(l)} + 2e^{-} \rightarrow \ce{H2}_{(g)} + 2\ce{OH}^{-}_{(aq)}\)
Karbon merupakan elektroda inert jadi tidak mengalami reaksi oksidasi maupun reaksi reduksi.
Anion \(\ce{SO4}^{2-}_{(aq)}\) merupakan sisa asam oksi maka yang mengalami reaksi oksidasi adalah air.
Reaksi oksidasi di anoda: \(2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-} \)
Soal 02
Tuliskan reaksi elektrolisis pada anoda dan katoda untuk larutan magnesium nitrat dengan elektroda Pt.
Reaksi ionisasi magnesium nitrat:
\(\ce{Mg(NO3)2}_{(aq)} \rightarrow \ce{Mg}^{2+}_{(aq)} + 2\ce{NO3}^{-}_{(aq)}\)
Terdapat kation \(\ce{Mg}^{2+}\). Karena magnesim termasuk logam aktif maka yang mengalami reaksi reduksi adalah air.
Reaksi reduksi di katoda: \(2\ce{H2O}_{(l)} + 2e^{-} \rightarrow \ce{H2}_{(g)} + 2\ce{OH}^{-}_{(aq)}\)
Pt merupakan elektroda inert jadi tidak mengalami reaksi oksidasi maupun reaksi reduksi.
Anion \(\ce{NO3}^{-}_{(aq)}\) merupakan sisa asam oksi maka yang mengalami reaksi oksidasi adalah air.
Reaksi oksidasi di anoda: \(2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-} \)
Soal 03
Tuliskan reaksi elektrolisis pada anoda dan katoda untuk larutan kalium iodida dengan elektroda grafit.
Reaksi ionisasi kalium iodida:
\(\ce{KI}_{(aq)} \rightarrow \ce{K}^{+}_{(aq)} + \ce{I}^{-}_{(aq)}\)
Terdapat kation \(\ce{K}^{+}\). Karena kalium termasuk logam aktif maka yang mengalami reaksi reduksi adalah air.
Reaksi reduksi di katoda: \(2\ce{H2O}_{(l)} + 2e^{-} \rightarrow \ce{H2}_{(g)} + 2\ce{OH}^{-}_{(aq)}\)
grafit merupakan elektroda inert jadi tidak mengalami reaksi oksidasi maupun reaksi reduksi.
Anion \(\ce{I}^{-}_{(aq)}\) merupakan sisa asam lain (bukan sisa asam oksi) maka yang mengalami reaksi oksidasi adalah anionnya.
Reaksi oksidasi di anoda: \(2\ce{I}^{-}_{(aq)} \rightarrow \ce{I2}_{(g)} + 2e^{-}\)
Soal 04
Pada elektrolisis larutan \(\ce{AgNO3}\) dengan elektroda Pt dialirkan arus listrik 10 A selama 30 menit.
(A) Buat reaksi elektrolisis di anoda dan katoda.
(B) Tentukan jumlah mol elektronnya.
(C) Tentukan massa endapan yang terbentuk.
(D) Tentukan volume gas yang dihasilkan pada kondisi STP
(Ar Ag = 108, O = 16, N = 14)
(A) Menulis reaksi elektrolisis
Reaksi ionisasi kalium iodida:
\(\ce{AgNO3}_{(aq)} \rightarrow \ce{Ag}^{+}_{(aq)} + \ce{NO3}^{-}_{(aq)}\)
Terdapat kation \(\ce{Ag}^{+}\). Karena perak bukan termasuk logam aktif maka yang mengalami reaksi reduksi adalah kation.
Reaksi reduksi di katoda: \(\ce{Ag}^{+}_{(aq)} + e \rightarrow \ce{Ag}_{(s)}\)
Pt merupakan elektroda inert jadi tidak mengalami reaksi oksidasi maupun reaksi reduksi.
Anion \(\ce{NO3}^{-}_{(aq)}\) merupakan sisa asam oksi maka yang mengalami reaksi oksidasi adalah air.
Reaksi oksidasi di anoda: \(2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-} \)
(B) Menentukan jumlah mol elektron
\(\text{Jumlah mol elektron} = \dfrac{i \cdot t}{96.500}\)
\(\text{Jumlah mol elektron} = \dfrac{10\cdot (30 \times 60)}{96.500}\)
\(\text{Jumlah mol elektron} = \dfrac{18.000}{96.500}\)
\(\text{Jumlah mol elektron} = 0,19 \text{ mol}\)
(C) Menentukan massa endapan yang terbentuk
Reaksi di katoda: \(\ce{Ag}^{+}_{(aq)} + e \rightarrow \ce{Ag}_{(s)}\)
Endapan yang terbentuk adalah endapan perak.
Perbandingan koefisien reaksi = perbandingan jumlah mol
Jumlah mol Ag = jumlah mol elektron
Jumlah mol Ag = 0,19 mol
Massa Ag = jumlah mol Ag × Ar Ag
Massa Ag = 0,19 × 108
Massa Ag = 20,52 gram
(D) Menentukan volume gas yang dihasilkan pada kondisi STP
Reaksi di anoda: \(2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-} \)
Gas yang dihasilkan dari reaksi oksidasi di atas adalah gas oksigen.
Perbandingan koefisien reaksi = perbandingan jumlah mol
Jumlah mol oksigen = \(\dfrac{1}{4} \times\) jumlah mol elektron
Jumlah mol oksigen = \(\dfrac{1}{4} \times 0,19\)
Jumlah mol oksigen = \(0,0475 \text{ mol}\)
Volume gas oksigen pada kondisi STP = mol gas × 22,4 L/mol
Volume gas oksigen pada kondisi STP = 0,0475 mol × 22,4 L/mol
Volume gas oksigen pada kondisi STP = 1,064 liter
Soal 05
Jika 1 liter larutan \(\ce{PbCl2}\) dielektrolisis menggunakan arus listrik sebesar 5 A pada elektroda grafit selama 30 menit, tentukan:
(A) Massa endapan yang terjadi di katoda
(B) Volume gas yang dihasilkan di anoda pada suhu 0°C tekanan 1 atm
(Ar Pb = 207, Ar Cl = 35,5)
Reaksi ionisasi larutan \(\ce{PbCl2}\)
\(\ce{PbCl2}_{\text{aq}} \rightarrow \ce{Pb}^{2+}_{\text{aq}} + 2\ce{Cl}^{-}_{\text{aq}}\)
Reaksi di katoda: \(\ce{Pb}^{2+}_{(aq)} + 2e \rightarrow \ce{Pb}_{(s)}\)
Endapan yang terbentuk adalah endapan timbal.
\(\text{Jumlah mol elektron} = \dfrac{i \cdot t}{96.500}\)
\(\text{Jumlah mol elektron} = \dfrac{5\cdot (30 \times 60)}{96.500}\)
\(\text{Jumlah mol elektron} = 0,093 \text{ mol}\)
Dengan menggunakan perbandingan koefisien reaksi,
\(\text{Jumlah mol timbal} = \dfrac{1}{2} \times \text{ mol elektron}\)
\(\text{Jumlah mol timbal} = \dfrac{1}{2} \times 0,093 \text{ mol}\)
\(\text{Jumlah mol timbal} = 0,0465 \text{ mol}\)
\(\text{massa timbal} = 0,0465 \text{ mol} \times 207 \text{ gram/mol}\)
\(\text{massa timbal} = 9,63 \text{ gram/mol}\)
(A) Jadi massa endapan yang terjadi di katoda adalah 9,63 gram
Reaksi di anoda: \(2\ce{Cl}^{-}_{(aq)} \rightarrow \ce{Cl2}_{(g)} + 2e^{-} \)
Gas yang dihasilkan dari reaksi oksidasi di atas adalah gas klorin.
Dengan menggunakan perbandingan koefisien reaksi,
\(\text{Jumlah mol gas klorin} = \dfrac{1}{2} \times \text{ mol elektron}\)
\(\text{Jumlah mol gas klorin} = \dfrac{1}{2} \times 0,093 \text{ mol}\)
\(\text{Jumlah mol gas klorin} = 0,0465 \text{ mol}\)
(B) Volume gas yang dihasilkan di anoda pada suhu 0°C tekanan 1 atm adalah kondisi STP.
Volume gas klorin pada kondisi STP = \(n \times 22,4 \text{ liter/mol}\)
Volume gas klorin pada kondisi STP = \(0,0465 \times 22,4 \text{ liter/mol}\)
Volume gas klorin pada kondisi STP = 1,04 liter
Soal 06
Ke dalam dua sel larutan tembaga (II) sulfat dan perak nitrat yang disusun seri dialirkan arus listrik yang sama dalam waktu yang sama, ternyata dapat mengendapkan 0,5 gram tembaga. Tentukan massa perak yang mengendap. (Ar Cu = 63,5, Ar Ag = 108).
Pada larutan pertama
\(\ce{CuSO4}_{\text{aq}} \rightarrow \ce{Cu}^{2+}_{\text{aq}} + \ce{SO4}^{2-}_{\text{aq}}\)
Reaksi di katoda: \(\ce{Cu}^{2+}_{(aq)} + 2e \rightarrow \ce{Cu}_{(s)}\)
Endapan yang terbentuk adalah endapan tembaga sebanyak 0,5 gram.
\(\text{Jumlah mol tembaga} = \dfrac{0,5 \text{ gram}}{63,5 \text{ gram/mol}}\)
\(\text{Jumlah mol tembaga} = \dfrac{1}{127} \text{ mol}\)
Gunakan perbandingan koefisien reaksi untuk menentukan jumlah mol elektron
\(\text{Jumlah mol elektron} = 2 \times \text{ jumlah mol tembaga}\)
\(\text{Jumlah mol elektron} = \dfrac{2}{127} \text{ mol}\)
Pada larutan kedua
\(\text{Jumlah mol elektron} = \dfrac{2}{127} \text{ mol}\)
\(\ce{AgNO3}_{\text{aq}} \rightarrow \ce{Ag}^{+}_{\text{aq}} + \ce{NO3}^{-}_{\text{aq}}\)
Reaksi di katoda: \(\ce{Ag}^{+}_{(aq)} + e \rightarrow \ce{Ag}_{(s)}\)
Endapan yang terbentuk adalah endapan perak.
Dengan menggunakan perbandingan koefisien reaksi dapat ditentukan jumlah mol perak yang dihasilkan.
\(\text{Jumlah mol perak} = \text{ jumlah mol elektron}\)
\(\text{Jumlah mol perak} = \dfrac{2}{127} \text{ mol}\)
\(\text{Massa perak yang mengendap} = \dfrac{2}{127} \text{ mol} \times 108 \text{ gram/mol}\)
\(\text{Massa perak yang mengendap} = 1,7 \text{ gram}\)
Soal 07
Elektrolisis 100 ml CuSO4 0,1 M dalam bejana A dan 100 ml larutan AgNO3 dalam bejana B dilakukan seri dengan menggunakan arus tetap 1 A pada anoda dan katoda Pt. Pada tiap-tiap katoda terbentuk endapan Cu dan Ag sementara pada anoda dihasilkan gas O2. (Ar Cu = 63,5; Ar Ag = 108; dan konstanta Faraday = 96500 C/mol). Setelah elektrolisis berlangsung 60 detik manakah pernyataan di bawah ini yang benar?
(1) Massa Cu yang mengendap lebih besar daripada massa Ag
(2) Jumlah atom Cu yang mengendap sama dengan jumlah atom Ag
(3) Volume gas O2 yang dihasilkan pada bejana A lebih besar daripada volume gas O2 yang dihasilkan pada bejana B.
(4) pH larutan dalam bejana A sama dengan pH larutan dalam bejana B
Jawaban: Pernyataan (1), (2), dan (3) salah sedangkan pernyataan (4) benar
\(\text{Jumlah mol elektron} = \dfrac{i \cdot t}{96.500}\)
\(\text{Jumlah mol elektron} = \dfrac{1\cdot 60}{96.500}\)
\(\text{Jumlah mol elektron} = 6,2 \times 10^{-4} \text{ mol}\)
Reaksi elektrolisis di bejana A
Pt merupakan elektroda inert jadi tidak mengalami reaksi oksidasi maupun reaksi reduksi.
Anion \(\ce{SO4}^{2-}_{(aq)}\) merupakan sisa asam oksi maka yang mengalami reaksi oksidasi adalah air.
Reaksi oksidasi di anoda: \(2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-} \)
Reaksi reduksi di katoda: \(\ce{Cu}_{\text{aq}}^{2+} + 2e^{-} \rightarrow \text{Cu}_{\text{(s)}}\)
Pada katoda dihasilkan endapan tembaga.
Gunakan perbandingan koefisien reaksi untuk menentukan jumlah mol tembaga.
Jumlah mol tembaga = ½ × jumlah mol elektron
Jumlah mol tembaga = ½ × \(6,2 \times 10^{-4} \text{ mol}\)
Jumlah mol tembaga =\(3,1 \times 10^{-4} \text{ mol}\)
Massa tembaga = \(3,1 \times 10^{-4} \text{ mol} \times 63,5 \text{ gram/mol}\)
Massa tembaga = 0,02 gram
Reaksi elektrolisis di bejana B
Pt merupakan elektroda inert jadi tidak mengalami reaksi oksidasi maupun reaksi reduksi.
Anion \(\ce{NO3}^{-}_{(aq)}\) merupakan sisa asam oksi maka yang mengalami reaksi oksidasi adalah air.
Reaksi oksidasi di anoda: \(2\ce{H2O}_{(l)} \rightarrow 4\ce{H}^{+}_{(aq)} + \ce{O2}_{(g)} + 4e^{-} \)
Reaksi reduksi di katoda: \(\ce{Ag}_{\text{aq}}^{+} + e^{-} \rightarrow \text{Ag}_{\text{(s)}}\)
Pada katoda dihasilkan endapan perak.
Jumlah mol perak = jumlah mol elektron =\(6,2 \times 10^{-4} \text{ mol}\)
Massa perak = \(6,2 \times 10^{-4} \text{ mol} \times 108 \text{ gram/mol}\)
Massa perak = 0,07 gram
(1) Massa Ag yang mengendap lebih besar daripada massa Cu
(2) Jumlah atom Ag lebih banyak
Jumlah atom Cu = \(3,1 \times 10^{-4} \text{ mol} \times 6,02 \times 10^{23} \text{ atom/mol}\)
Jumlah atom Ag = \(6,2 \times 10^{-4} \text{ mol} \times 6,02 \times 10^{23} \text{ atom/mol}\)
(3) Volume gas O2 yang dihasilkan pada bejana A sama dengan volume gas O2 yang dihasilkan pada bejana B (karena reaksi oksidasinya sama)
(4) pH larutan dalam bejana A sama dengan pH larutan dalam bejana B (karena reaksi oksidasinya sama sehingga dihasilkan jumlah mol ion \(\color{blue}\ce{H}^{+}\) yang sama)
