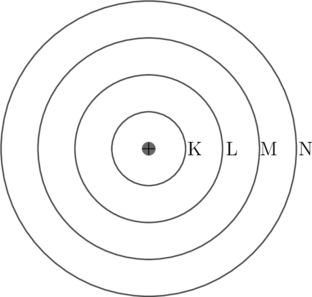
Pada model atom Niels Bohr elektron mengelilingi inti atom pada lintasan-lintasan tertentu. Lintasan ini disebut sebagai kulit atom. Kulit yang pertama disebut sebagai kulit K, kulit yang kedua disebut sebagai kulit L, kulit yang ketiga disebut kulit M, dan kulit yang keempat disebut sebagai kulit N.
Jumlah maksimum elektron pada setiap kulit memenuhi rumus \(2n^2\), dengan \(n\) adalah nomor kulit.
- Elektron yang berpindah dari kulit dalam ke kulit luar misalkan dari kulit L ke kulit M akan menyerap energi.
- Elektron yang berpindah dari kulit luar ke kulit dalam misalkan dari kulit M ke kulit L akan melepas energi
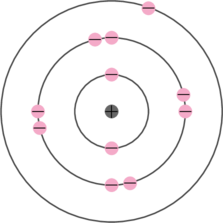
- Kulit pertama terisi 2 elektron
- Kulit kedua terisi 8 elektron
- Kulit ketiga terisi 1 elektron. Elektron yang berada di kulit terluar ini disebut dengan elektron valensi
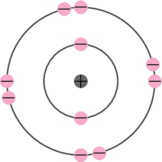
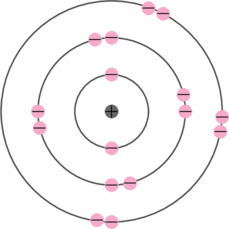
- Kulit pertama terisi 2 elektron
- Kulit kedua terisi 8 elektron
- Kulit ketiga terisi 6 elektron. Elektron yang berada di kulit terluar ini disebut dengan elektron valensi

