Teori Atom Dalton

- Setiap materi tersusun atom-atom yang sudah tidak dapat terbagi lagi
- Atom-atom dari suatu unsur adalah identik dan memiliki massa serta sifat yang sama
- Senyawa adalah kombinasi dari dua atau lebih atom yang tidak sejenis
- Reaksi kimia merupakan pemisahan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan dan tidak dapat dimusnahkan
- Tidak menjelaskan adanya partikel subatomik (partikel penyusun atom)
- Tidak menjelaskan sifat listrik materi
- Tidak menjelaskan cara atom-atom saling berikatan
- Tidak menjelaskan perbedaan antara atom unsur yang satu dengan yang lain
Teori Atom Thomson
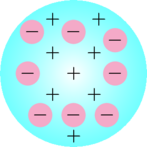
- Suatu atom dimodelkan sebagai bola pejal yang bermuatan positif dengan elektron-elektron yang tersebar di dalamnya
- Suatu atom bermuatan netral karena jumlah muatan positif sama dengan jumlah muatan negatif
- Tidak dapat menjelaskan stabilitas atom karena model atomnya tidak menggambarkan bagaimana partikel bermuatan positif mampu menahan partikel bermuatan negatif di dalam atom
- Tidak menjelaskan pergerakan elektron
Teori Atom Rutherford
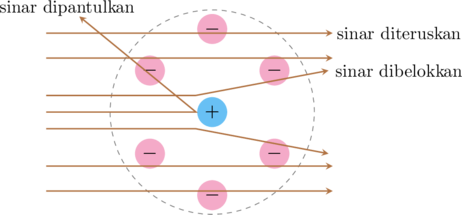
- Sebagian besar sinar alfa yang ditembakkan pada lempeng emas akan diteruskan. Hal ini menunjukkan bahwa sebagian besar ruang dalam atom merupakan ruang yang kosong
- Sebagian kecil sinar alfa dibelokkan karena adanya gaya tolak inti
- Ada sinar alfa yang dipantulkan karena tepat menumbuk inti atom. Inti atom menempati ruang yang sangat kecil dalam atom. Massa atom terpusat pada inti atom.
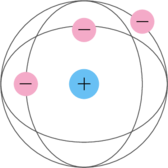
- Atom terdiri atas inti atom yang bermuatan positif dan elektron-elektron yang bergerak mengelilinginya
- Sebagian besar masa atom terpusat pada inti atom
- Jumlah muatan positif pada inti atom sama dengan jumlah muatan negatif, sehingga atom bersifat netral
Teori Atom Bohr
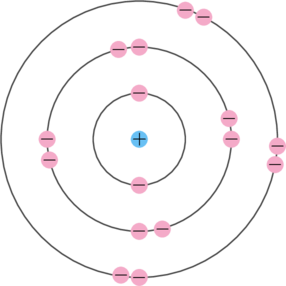
- Elektron bergerak mengelilingi inti atom pada lintasan-lintasan dengan tingkat energi tertentu.
- Selama bergerak pada lintasan stasioner, elektron tidak menyerap maupun memancarkan energi. Model atom Bohr ini mirip dengan sistem tata surya.
- Elektron dapat berpindah lintasan dengan menyerap atau melepaskan energi. Elektron akan menyerap energi jika berpindah dari lintasan yang tingkat energinya rendah ke lintasan yang tingkat energinya tinggi. Elektron akan melepas energi jika berpindah dari lintasan yang tingkat energinya tinggi ke lintasan yang tingkat energinya rendah.
Teori Atom Modern (Mekanika Kuantum)

- Atom terdiri dari partikel subatomik yaitu proton dan neutron yang membentuk inti atom dan elektron yang bergerak mengelilingi inti pada orbital-orbital tertentu yang membentuk kulit atom.
- Orbital adalah daerah yang memiliki peluang terbesar ditemukannya elektron
- Kedudukan elektron pada setiap orbital dinyatakan dengan bilangan kuantum
