Titrasi asam basa dapat digunakan untuk menentukan konsentrasi suatu larutan asam atau basa yang belum diketahui dengan menggunakan larutan asam atau basa yang standar (larutan yang sudah diketahui konsentrasinya) melalui reaksi asam basa.
Alat dan bahan yang digunakan:
(1) Buret
Buret berisi larutan standar yang telah diketahui konsentrasinya disebut dengan titran
(2) Labu Erlenmeyer
Labu erlenmeyer berisi larutan sampel yang akan dianalisis atau ditentukan konsentrasinya disebut dengan titrat
(3) Statif dan klem
Statif dan klem digunakan untuk menyangga buret.
(4) Indikator Kimia
Indikator kimia digunakan untuk mengetahui kapan larutan sampel (titrat) tepat habis bereaksi. Titik ekuivalen dicapai saat jumlah mol \(\ce{H}^{+}\) (asam) sama dengan jumlah mol \(\ce{OH}^{-}\) (basa).
Rumus untuk mengetahui konsentrasi titrat:
$$\bbox[yellow, 5px, border: 2px solid red]{\text{M}_1 \cdot \text{V}_1 \cdot \text{ valensi } = \text{M}_2 \cdot \text{V}_2 \cdot \text{ valensi }}$$
Kurva Titrasi Asam Basa
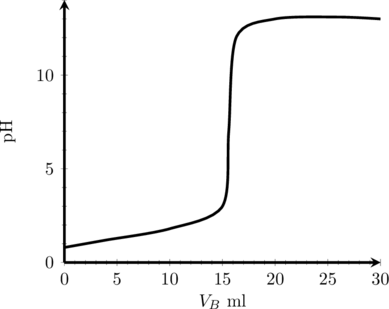
(1) Titrasi Asam Kuat oleh Basa Kuat
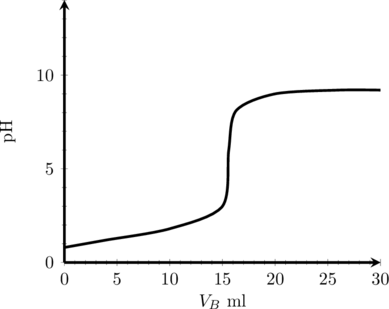
(2) Titrasi Asam Kuat oleh Basa Lemah
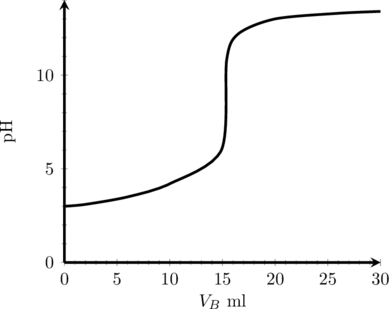
(3) Titrasi Asam Lemah oleh Basa Kuat
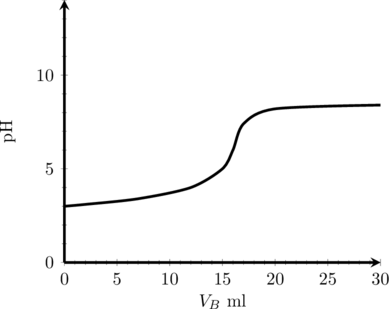
(4) Titrasi Asam Lemah oleh Basa Lemah
Latihan Soal
Soal 01
Pada proses titrasi jika jumlah mol \(\ce{H}^{+}\) sama dengan jumlah mol \(\ce{OH}^{-}\) maka keadaan tersebut disebut sebagai…
(A) titik awal titrasi
(B) titik ekuivalen
(C) titik basa
(D) titik akhir titrasi
(E) titik asam
Jawaban: B
Soal 02
Untuk menetralkan 20 ml asam sulfat diperlukan 20 ml natrium hidroksida 0,2 M. Konsentrasi asam sulfat tersebut adalah…
(A) 0,1 M
(B) 0,15 M
(C) 0,2 M
(D) 0,25 M
(E) 0,3 M
Jawaban: A
jumlah mol \(\ce{H}^{+}\) = jumlah mol \(\ce{OH}^{-}\)
Misal konsentrasi asam sulfat tersebut adalah \(M_1\) dan konsentrasi natrium hidroksida adalah \(M_2\)
\(\color{blue} M_1 \cdot V_1 \cdot \text{ valensi } = M_2 \cdot V_2\cdot \text{ valensi }\)
\(M_1 \cdot 20 \text{ ml } \cdot (2) = 0,2 \text{ M } \cdot 20 \text{ ml }\cdot (1)\)
\(M_1 \cdot 40 = 4\)
\(M_1 = \dfrac{4}{40} = 0,1 \text{ M}\)
Soal 03
Sebanyak 40 ml NaOH 0,2 M dicampurkan dengan 60 ml HCl 0,05 M. Volume asam sulfat 0,1 M yang dibutuhkan untuk menetralkan campuran tersebut adalah…
(A) 10 ml
(B) 15 ml
(C) 20 ml
(D) 25 ml
(E) 30 ml
Jawaban: D
| \(\ce{NaOH}_{(aq)}\) | + | \(\ce{HCl}_{(aq)}\) | \(\rightarrow\) | \(\ce{NaCl}_{(aq)}\) | + | \(\ce{H2O}_{(l)}\) | |
| Mula-mula | 8 mmol | 3 mmol | − | − | |||
| Reaksi | 3 mmol | 3 mmol | 3 mmol | ||||
| Sisa | 5 mmol | 0 | 3 mmol |
Terdapat sisa \(\ce{NaOH}\) sebanyak 5 mmol sehingga larutan bersifat basa. 5 mmol natrium hidroksida ini kemudian akan dinetralkan oleh asam sulfat 0,1 M.
jumlah mol \(\ce{OH}^{-}\) = jumlah mol \(\ce{H}^{+}\)
\(\color{blue} M_1 \cdot V_1 \cdot \text{ valensi } = M_2 \cdot V_2\cdot \text{ valensi }\)
\(5 \text{ mmol } = 0,1 \text{ M } \cdot x \text{ ml }\cdot (2)\)
\(5 = 0,2x\)
\(x = \dfrac{5}{0,2}\)
\(x = 25 \text{ ml}\)
Jadi, volume asam sulfat yang dibutuhkan adalah 25 ml
Soal 04
Berikut ini data hasil titrasi larutan \(\ce{CH3COOH}\) dengan larutan \(\ce{Ca(OH)2}\) 0,1 M
| Percobaan | Volume \(\ce{CH3COOH}\) yang dititrasi | Volume \(\ce{Ca(OH)2}\) yang digunakan |
| 1 | 25 ml | 10 ml |
| 2 | 25 ml | 11 ml |
| 3 | 25 ml | 12 ml |
Berdasarkan data tersebut, konsentrasi larutan \(\ce{CH3COOH}\) sebesar…
(A) 0,02 M
(B) 0,088 M
(C) 0,12 M
(D) 0,25 M
(E) 0,40 M
Jawaban: B
Menghitung volume rata-rata \(\ce{Ca(OH)2}\):
\(V_2 = \dfrac{10 + 11 + 12}{3} = 11 \text{ ml}\)
Gunakan rumus:
jumlah mol \(\ce{H}^{+}\) = jumlah mol \(\ce{OH}^{-}\)
\(\color{blue} M_1 \cdot V_1 \cdot \text{ valensi } = M_2 \cdot V_2\cdot \text{ valensi }\)
\(M_1 \cdot 25 \text{ ml } \cdot (1) = 0,1 \cdot 11 \text{ ml }\cdot (2)\)
\(25 \cdot M_1 = 2,2\)
\(M_1 = \dfrac{2,2}{25}\)
\(M_1 = 0,088\text{ molar}\)
Soal 05
Berikut ini data hasil titrasi larutan \(\ce{HCl}\) dengan larutan \(\ce{NaOH}\) 0,1 M
| Percobaan | Volume \(\ce{HCl}\) yang dititrasi | Volume \(\ce{NaOH}\) yang digunakan |
| 1 | 20 ml | 15 ml |
| 2 | 20 ml | 14 ml |
| 3 | 20 ml | 16 ml |
Berdasarkan data tersebut, konsentrasi larutan \(\ce{HCl}\) sebesar…
(A) 0,070 M
(B) 0,075 M
(C) 0,080 M
(D) 0,133 M
(E) 0,143 M
Jawaban: B
Menghitung volume rata-rata \(\ce{NaOH}\):
\(V_2 = \dfrac{15 + 14 + 16}{3} = 15 \text{ ml}\)
Gunakan rumus:
jumlah mol \(\ce{H}^{+}\) = jumlah mol \(\ce{OH}^{-}\)
\(\color{blue} M_1 \cdot V_1 \cdot \text{ valensi } = M_2 \cdot V_2\cdot \text{ valensi }\)
\(M_1 \cdot 20 \text{ ml } \cdot (1) = 0,1 \cdot 15 \text{ ml }\cdot (1)\)
\(20 \cdot M_1 = 1,5\)
\(M_1 = \dfrac{1,5}{20}\)
\(M_1 = 0,075\text{ molar}\)
Soal 06
Sebanyak 4 gram cuplikan KOH dilarutkan dalam 100 ml air. Selanjutnya, 10 ml larutan tersebut dititrasi dengan larutan \(\ce{HNO3}\) 0,2 M dan diperoleh data sebagai berikut.
| Percobaan | Volume \(\ce{KOH}\) yang dititrasi | Volume \(\ce{HNO3}\) yang digunakan |
| 1 | 10 ml | 21 ml |
| 2 | 10 ml | 20 ml |
| 3 | 10 ml | 19 ml |
Kadar KOH dalam cuplikan tersebut adalah…
(Mr KOH = 56)
(A) 14 %
(B) 28 %
(C) 56 %
(D) 70 %
(E) 84 %
Jawaban: C
Menghitung konsentrasi larutan KOH 10 ml
\(\color{blue} M_1 \cdot V_1 \cdot \text{ valensi } = M_2 \cdot V_2\cdot \text{ valensi }\)
\(M_1 \cdot 10 \text{ ml }\cdot (1) = 0,2 \text{ M } \cdot 20 \text{ ml }\cdot (1)\)
\(10 \cdot M_1 = 4\)
\(M_1 = \dfrac{4}{10} = 0,4 \text{ M}\)
Karena konsentrasi KOH dalam 10 ml larutannya adalah 0,4 M, maka konsentrasi KOH dalam 100 ml larutannya juga 0,4 M.
Selanjutnya menghitung jumlah mol KOH,
\(n = M \cdot V\)
\(n = 0,4 \cdot 0,1\)
\(n = 0,04 \text{ mol}\)
Massa KOH = n × Mr
Massa KOH = 0,04 × 56
Massa KOH = 2,24 gram
Kadar KOH = \(\dfrac{2,24}{4} \times 100 \%\)
Kadar KOH = 56%
Soal 07
Dari suatu batuan yang mengandung \(\ce{NaOH}\) diambil sebanyak 5 gram, kemudian dilarutkan ke dalam air sehingga diperoleh larutan sebanyak 500 ml. 10 ml larutan tersebut di titrasi dengan mempergunakan 5 ml larutan \(\ce{HCl}\) 0,1 M. Jika reaksi yang terjadi:
\(\ce{NaOH}_{(aq)} + \ce{HCl}_{(aq)} \rightarrow \ce{NaCl}_{(aq)} + \ce{H2O}_{(l)}\)
Maka kadar \(\ce{NaOH}\) yang terdapat dalam 5 gram cuplikan tersebut adalah…
(A) 20%
(B) 40%
(C) 60%
(D) 80%
(E) 100%
Jawaban: A
Gunakan rumus:
jumlah mol \(\ce{OH}^{-}\) = jumlah mol \(\ce{H}^{+}\)
\(\color{blue} M_1 \cdot V_1 \cdot \text{ valensi } = M_2 \cdot V_2\cdot \text{ valensi }\)
\(M_1 \cdot 10 \text{ ml } \cdot (1) = 0,1 \cdot 5 \text{ ml } \cdot (1)\)
\(M_1 \cdot 10 = 0,5\)
\(M_1 = \dfrac{0,5}{10}\)
\(M_1 = 0,05 \text{ M}\)
10 ml NaOH konsentrasi/kepekatan larutannya adalah 0,05 M
dalam 500 ml larutan NaOH konsentrasinya juga sama, yaitu 0,05 M. Kita dapat menghitung jumlah mol NaOH terlebih dahulu.
\(n = M \cdot V\)
\(n = 0,05 \cdot 0,5\)
\(n = 0,025 \text{ mol}\)
Menghitung massa NaOH,
\(m = n \cdot \text{ Mr NaOH}\)
\(m = 0,025 \cdot 40 = 1 \text{ gram}\)
Kadar NaOH = \(\dfrac{1 \text{ gram}}{5 \text{ gram}} \times 100 \%\)
Kadar NaOH = 20%
